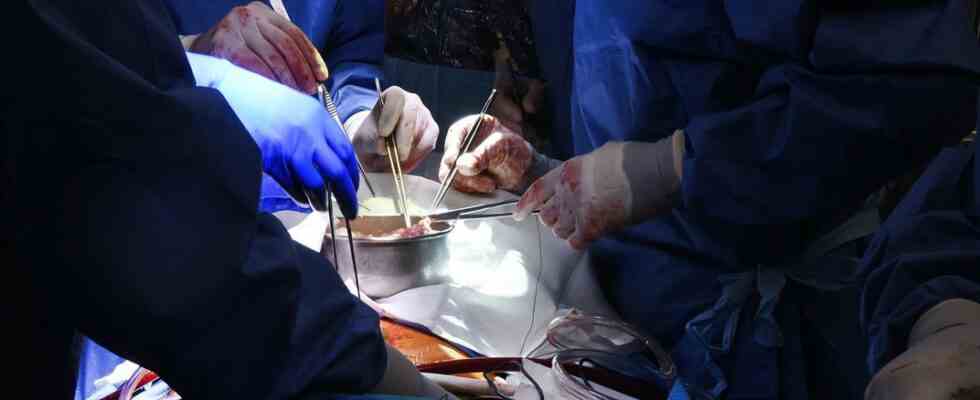
Le chirurgien Bartley Griffith examine le cœur du cochon avant la greffe.
École de médecine de l’Université du Maryland
Bartley Griffith est un chirurgien cardiaque à l’Université du Maryland, à Baltimore, qui dit qu’il a probablement effectué plus d’un millier de transplantations cardiaques au cours d’une carrière s’étalant sur quatre décennies. Mais le 7 janvier de cette année-là, Griffith a effectué une opération pas comme les autres. Il a transplanté un cœur de porc dans un être humain pour la première fois.
Lorsque Griffith a desserré le nouveau cœur de son patient de 57 ans, le sang s’est précipité dans les artères coronaires de David Bennett, transformant l’organe de porc pâle et sans vie en une pompe vibrante et écarlate. « Le cœur battait vite », dit Griffith.
Mais 60 jours plus tard, Bennett est décédé et les médecins n’ont pas pu déterminer une cause précise de décès. Les réponses ne font qu’émerger maintenant que l’équipe de Griffith a publié son rapport sur l’opération historique en Le New England Journal of Medicine. Considérer les raisons pour lesquelles Bennett est peut-être décédé aidera les médecins à se préparer aux futures greffes de cœur de porc.
La «xénotransplantation cardiaque», ou le transfert d’un cœur entre espèces, a été réalisée pour la première fois chez un receveur humain en 1964 lorsque le chirurgien de l’Université du Mississippi, James Hardy, a implanté un cœur de chimpanzé chez Boyd Rush, âgé de 68 ans. Au moins huit autres xénotransplantations cardiaques similaires ont eu lieu au cours du demi-siècle suivant, dont aucune n’a vraiment réussi.
Cependant, avec les capacités d’édition de gènes de CRISPR, les choses étaient différentes cette fois. La société de biotechnologie Revovicor a conçu des porcs avec 10 modifications génétiques, supprimé quatre gènes porcins et ajouté six gènes humains pour rendre leurs organes plus compatibles avec les humains. Bennett, qui souffrait d’insuffisance cardiaque en phase terminale, n’était pas éligible pour un cœur humain parce qu’il n’avait pas suivi les ordres de ses médecins dans le passé. Ainsi, sur son lit de mort et sans autre option, Bennett a obtenu un cœur de l’un des porcs Revivicor sous l’approbation d’utilisation compassionnelle de la Food and Drug Administration (FDA), qui permet des traitements expérimentaux pour les urgences.
Actuellement, 17 personnes sur la liste d’attente de greffe meurent chaque jour, et la xénotransplantation, si elle est pleinement mise en œuvre, pourrait mettre fin à la pénurie nationale de 100 000 organes avec un approvisionnement presque illimité de porcs. Si ces greffes d’organes de porc doivent un jour remplacer les greffes d’homme à homme, les scientifiques doivent apprendre à rendre la xénotransplantation sûre, accessible et véritablement prolongée.
L’attention est donc naturellement passée de la nouveauté de l’opération de Griffith à la tentative de comprendre la cause du décès de Bennett. Le récit de Griffith expose clairement les faits de l’affaire : les capillaires autour du cœur de Bennett ont explosé, provoquant une fuite de liquide et un doublement de son cœur. Comme ces capillaires rompus fournissaient de l’oxygène au cœur, les cellules du muscle cardiaque ont commencé à mourir en leur absence. Au jour 60, l’équipe de Griffith a retiré le système de survie car le cœur de Bennett a été endommagé de manière irréversible.
Mais pourquoi est-ce arrivé ? « Nous ne savons toujours pas avec certitude », admet Griffith. Son article envisage trois possibilités principales, mais il existe également une quatrième explication unificatrice.
Des chirurgiens transplantent un cœur de porc à David Bennett.
École de médecine de l’Université du Maryland
Le rejet d’organe peut avoir eu lieu
L’un des plus gros problèmes de toute greffe est le risque de rejet lorsque le système immunitaire de l’organisme prend l’organe du donneur pour un organe étranger et le détruit. À moins que le donneur et le receveur ne soient des jumeaux identiques, un certain rejet est inévitable, mais les médecins peuvent généralement limiter le rejet d’organe avec des médicaments qui suppriment le système immunitaire du patient.
Dans la xénogreffe de Bennett, les modifications génétiques de Revivicor ont « humanisé » le cœur de son cochon pour provoquer une réponse immunitaire réduite, et l’équipe de Griffith lui a donné un cocktail de médicaments immunosuppresseurs pour une protection supplémentaire. En conséquence, Bennett a assez bien toléré son nouvel organe pendant le premier mois et les biopsies n’ont jamais montré de signes de rejet aigu, selon Griffith.
Mais il existe des preuves que le rejet s’est effectivement produit, selon le pionnier de la xénotransplantation David Cooper, dont les premiers travaux ont contribué à stimuler les efforts de génie génétique pour rendre les organes de porc plus humains. Le rapport de Griffith indique que des capillaires endommagés et un cœur enflé « ne sont pas compatibles avec un rejet typique », mais Cooper, qui est également chercheur principal au Massachusetts General Hospital, affirme que ces résultats sont des signes classiques de rejet d’organes lors d’expériences de xénotransplantation il y a 30 ans. Cooper pense qu’une immunosuppression inadéquate au fil du temps, peut-être due au manque d’expérience des professionnels de la santé avec cette nouvelle expérience, peut avoir contribué au rejet d’organe dans le cas de Bennett.
Les anticorps anti-porc pourraient avoir attaqué le cœur
Au jour 43 après la chirurgie, Bennett a reçu ce qu’on appelle une immunoglobuline intraveineuse (IgIV) pour traiter une éventuelle infection. Fabriqué à partir de dons de sang de milliers de personnes, l’IgIV est une thérapie par anticorps hautement concentrée administrée pour renforcer le système immunitaire affaibli d’un patient.
La chirurgie de transplantation consiste à équilibrer le double risque de rejet d’organe et d’infection : si le système immunitaire est trop fort, il détruira l’organe, mais s’il est trop faible, le patient mourra de l’infection. Dans ce cas, l’équipe de Griffith a peut-être exagéré l’immunosuppression au départ, ils ont donc dû donner des IgIV pour renforcer le système immunitaire de Bennett et l’aider à combattre ses infections.
Le problème est qu’en plus d’une variété d’anticorps, les IgIV contiennent naturellement des anticorps anti-porc qui peuvent avoir attaqué le cœur de Bennett. Griffith s’empresse de souligner que les IVIG ne semblent pas tuer les cellules porcines dans les tests de Revovicor. Mais il reconnaît également que dans la vraie vie, les anticorps anti-porc d’IVIG pourraient néanmoins cibler et détruire le cœur du porc, tuant Bennett.
Un virus porcin aurait pu rompre le cœur
L’une des infections les plus dangereuses que Bennett a contractées était le cytomégalovirus porcin (pCMV). Le virus ne se trouve que chez les porcs et n’affecte généralement pas leur santé à part les éternuements et l’écoulement nasal. Mais si le pCMV pénètre chez l’homme, il pourrait théoriquement déclencher une pandémie mortelle. Revivicor prend donc de grandes précautions lors de l’élevage de porcs pour la xénotransplantation, par ex. B. en les hébergeant dans des installations biosécurisées et en testant les agents pathogènes avec des prélèvements nasaux réguliers.
Mais ces tests de virus n’ont peut-être pas été assez rigoureux. Mike Curtis, PDG de la société de xénotransplantation eGenesis, affirme que les écouvillons nasaux ne peuvent pas détecter les infections dormantes chez les porcs adultes, il a donc été surpris de savoir pourquoi Revovicor les avait utilisés. Au lieu de cela, des tests sanguins réels auraient dû être effectués pour s’assurer que le porc donneur n’avait aucun type de pCMV, dit Curtis.
Griffith pense que le cœur du porc a peut-être été infecté par une forme inactivée de pCMV qui, alors qu’il se trouvait dans le corps immunodéprimé de Bennett, « s’est réveillé, a rompu certains capillaires et tué le cœur », dit-il.
Bennett était peut-être trop malade pour bénéficier de l’organe
« Laquelle de ces choses en était la cause? » demande Curtis, faisant référence aux trois possibilités envisagées dans le rapport. « Peut-être que ce n’en était pas un, mais c’était une combinaison de tout. »
Cooper pense qu’il y a une explication plus simple. « Ils ont choisi un patient qui était trop affaibli pour subir cette procédure », dit-il.
Bennett avait été confiné à son lit d’hôpital pendant deux mois avant son opération car son état était si mauvais qu’il avait besoin d’ECMO (oxygénation par membrane extracorporelle) pour remplacer la fonction de son cœur et de ses poumons. Bien que l’ECMO soit une technologie vitale, une utilisation à long terme entraîne une détérioration progressive des organes. Des saignements dans son tube digestif et une infection bactérienne dans son sang ont également probablement affaibli Bennett avant l’opération. « Les chances étaient contre nous dès le début », a déclaré Cooper à propos de l’équipe de Griffith. « Vous devez choisir un patient qui a une chance réaliste de bien faire. »
Griffith reconnaît également que « David était presque trop malade pour en bénéficier », mais il présente cette xénotransplantation comme une opportunité d’apprentissage. au rejet, aux IgIV, à l’infection ou à tout ce qui précède.
Et après?
Le cours postopératoire de Bennett a été marqué par de nombreuses tentatives pour lui sauver la vie. Il avait besoin d’une dialyse continue parce que ses reins étaient défaillants. Il a dû subir une intervention chirurgicale abdominale d’urgence parce qu’il avait des douleurs abdominales inexpliquées. Il a dû redémarrer l’ECMO lorsque son cœur a commencé à se détériorer. « Les deux mois de ce patient ont dû être un cauchemar pour lui et pour l’équipe médicale », déclare Cooper. Il ne pense pas qu’il y ait beaucoup d’intérêt à ce qu’un autre patient souffrant de la même maladie subisse une greffe de cœur de porc. Au lieu de cela, Cooper pense que les chirurgiens devraient passer directement aux essais cliniques avec des patients « qui sont dans un état raisonnablement bon et qui ont une chance raisonnable de bien s’en sortir ».
Griffith estime qu’il faudra au moins un an et demi avant que la FDA n’approuve un essai clinique de xénotransplantation, mais plutôt que d’attendre aussi longtemps, il a l’intention de poursuivre ces chirurgies ponctuelles dans l’intervalle. Comme la meilleure façon d’apprendre est par la pratique, Griffith pense que chaque xénogreffe supplémentaire au cours des 18 prochains mois lui permettra de mieux optimiser la survie des patients dans l’étude finale. Bien sûr, la seule façon d’acquérir plus d’expérience à ce stade est d’opérer des patients à usage compassionnel qui, comme Bennett, n’ont pas d’autres options.
« Les patients sont une source remarquable de courage ; Ils nous encouragent, nous les médecins, parce qu’ils sont prêts à aller de l’avant même lorsqu’ils n’ont peut-être pas l’occasion de faire boule de neige », déclare Griffith. « Ils le font encore parce que c’est mieux qu’une mort certaine. »
vidéos recommandées
The post Pourquoi exactement le premier patient humain qui a reçu un cœur de porc est-il mort ? | La science est apparue en premier sur Germanic News.