De la même manière que ce qui avait déjà été identifié chez d’autres espèces, qui disposent d’un mécanisme cellulaire pour « retarder » la croissance et la naissance de la progéniture jusqu’à ce que les conditions soient optimales dans l’environnement, une nouvelle étude a découvert le même « bouton pause » moléculaire pour la croissance. dans les embryons humains. Les résultats pourraient changer notre compréhension de certains problèmes liés à la grossesse et au développement moléculaire précoce.
Une équipe scientifique de l’Institut Max Planck de génétique moléculaire (MPIMG) à Berlin, en Allemagne, et de l’Institut de biotechnologie moléculaire (IMBA) à Vienne, en Autriche, a publié une nouvelle étude dans la revue Cell dans laquelle elle décrit la découverte d’un changement moléculaire de la croissance chez les embryons humainsqui jusqu’à présent n’avait été découvert que chez d’autres espèces.
L’identification de ce «bouton pause » dans le développement humain culmine une longue controverse scientifique sur son existence, démontrant que cet interrupteur présent chez d’autres animaux peut également être activé dans les cellules humaines. Les résultats de la recherche ont des implications significatives pour notre compréhension des débuts de la vie humaine et pourraient même optimiser les technologies de reproduction, selon une étude. communiqué de presse.
Embryons latents
On sait que chez certains mammifères, la progression du développement embryonnaire peut être modifiée pour améliorer les chances de survie de l’embryon et de la mère. Ce mécanisme pour développement temporairement ralentiappelé diapause embryonnairea lieu au stade du blastocyste, avant que l’embryon ne s’implante dans l’utérus. Pendant toute la diapause, l’embryon flotte librement et la grossesse prolonge sa durée.
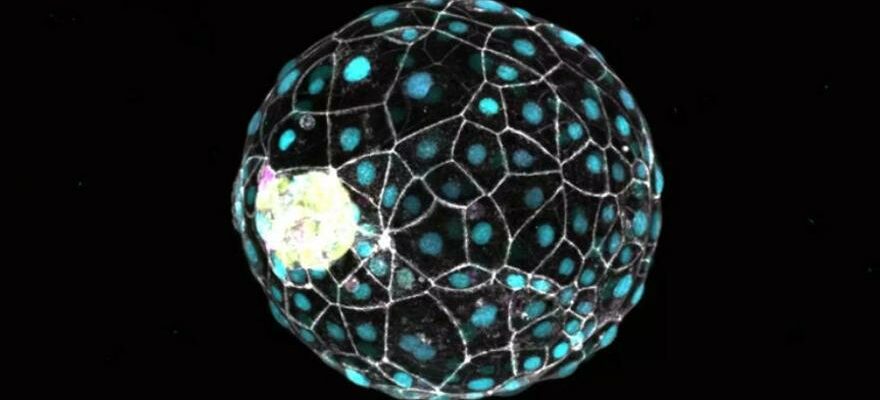
Il latence dans lequel l’embryon est conservé peut être maintenu pendant des semaines ou des mois : le développement ne reprend que lorsque les conditions sont favorables. Aujourd’hui, les scientifiques ont vérifié expérimentalement cette diapause à l’aide de cellules souches humaines et de modèles de blastocystes basés sur des cellules souches appelés blastoïdesqui représentent un embryon de cinq à sept jours et constituent une alternative à l’utilisation directe de embryons humains pour la recherche, ce qui implique différents dilemmes éthiques.
Les spécialistes concluent que tous les mécanismes moléculaires qui contrôlent la diapause embryonnaire peuvent également être mis en mouvement dans les cellules humaines : selon une étude article publié dans Science Alert, la clé est un molécule appel mTORi. Lorsque les chercheurs ont exposé les blastoïdes à mTORi, ils sont entrés dans une sorte d’hibernation qui a duré jusqu’à huit jours en laboratoire.
Un vestige d’anciens processus évolutifs
Bien que la croissance et la division cellulaire aient ralenti, le blastoïde réactivé était toujours capable de s’attacher aux cellules de l’endomètre comme le ferait un embryon à ce stade de développement. Au moment où l’équipe de scientifiques a arrêté de fournir mTORi aux blastoïdes, ils se sont immédiatement « réveillés » et reprise des opérations normales.
Les scientifiques pensent que ce changement de croissance dans les cellules humaines pourrait être un vestige de processus évolutifs que nous n’utilisons plus. Par conséquent, nous avons perdu la capacité d’entrer naturellement dans cet état latent, mais les expériences montrent que nous conservons cet état interne et que nous pourrions le favoriser.
Les découvertes pourraient avoir des implications pour médecine reproductivePar exemple, les spécialistes pensent que le déclenchement d’un état de dormance lors d’une procédure de fécondation in vitro (FIV) pourrait offrir une fenêtre de temps plus large pour évaluer les conditions de développement de l’embryon et le synchroniser avec la mère, obtenant ainsi une meilleure implantation dans l’utérus.
Référence
L’activité mTOR rythme la progression du développement du stade du blastocyste humain. Dhanur P. Iyer et al. Cellule (2024). DOI :https://doi.org/10.1016/j.cell.2024.08.048