Der Einsatz von KI im Gesundheitswesen ist ein heikles Geschäft. In der Onkologie ist das noch schwieriger, da hier besonders viel auf dem Spiel steht. Biotech-Startup Valar Labs hat hohe Ziele, beginnt aber klein mit einem Tool, das bestimmte Behandlungsergebnisse genau vorhersagt und den Patienten so möglicherweise wertvolle Zeit spart. Das Unternehmen hat 22 Millionen Dollar aufgebracht, um sein Angebot auf neue Krebsarten und Therapien auszuweiten.
Jeder Krebs ist anders, aber bei vielen gibt es bewährte Verfahren, die über Jahre hinweg getestet wurden. Manchmal bedeutet das jedoch, dass man sich über Monate hinweg einer bestimmten Behandlungsmethode unterziehen muss, um herauszufinden, ob sie wirkt.
Blasenkrebs ist eine davon, erklärten die Mitbegründer von Valar gegenüber Tech. Eine häufige Erstbehandlung, die von Onkologen empfohlen wird, die sogenannte BCG-Therapie, hat eine Erfolgswahrscheinlichkeit von etwa einem Münzwurf – was eigentlich ziemlich gut ist! Aber wäre es nicht schön, diese Münze gar nicht erst werfen zu müssen? Dieses Problem versucht Valar zu lösen.
CEO Anirudh Joshi sagte, das Team habe sich in Stanford kennengelernt, wo sie sich mit der KI-Unterstützung für klinische Entscheidungen beschäftigten. Mit anderen Worten: Es gehe darum, sowohl Patienten als auch Ärzten bei der Entscheidung zu helfen, welchen Behandlungsweg sie wählen sollen, egal ob es zwei oder ein Dutzend sind.
„Wir haben gelernt, dass der Behandlungsplan der meisten Krebspatienten heute wirklich unklar ist“, sagte Joshi. „Sie haben Optionen, aber es ist schwer zu sagen, was gut wirkt – man muss einfach Dinge ausprobieren. Unsere ganze Idee war es also, dies zu einer fundierten Entscheidung zu machen. Bei der Behandlung von Blasenkrebs reagiert nur einer von zwei Patienten auf die Standardbehandlung. Wenn wir wüssten, welcher Patient welcher ist, müssten wir nicht ein Jahr Therapie mit etwas verschwenden, das nicht funktioniert.“
Der erste Test, den sie entwickelt haben, heißt Vesta und ist auf diese spezielle Situation ausgerichtet. Und es handelt sich nicht um irgendeine theoretische Softwarelösung: Das Team arbeitete mit einem Dutzend medizinischer Zentren auf der ganzen Welt zusammen, um über 1.000 Patienten zu untersuchen und herauszufinden, wie sie genau auf bestimmte Therapien reagieren.
Der Prozess besteht aus zwei Komponenten: Erstens wird eine visuelle KI (oder ein Computervisionsmodell) anhand von Tausenden histologischen Bildern von Krebspatienten trainiert. Diese dünnen Scheiben des betroffenen Gewebes werden zunehmend von Experten gescannt und untersucht, obwohl der Prozess eher ungenau sein kann.
„Dieses Bild mit superhoher Auflösung verrät viel darüber, was auf zellulärer Ebene eines Tumors passiert“, erklärt CTO Viswesh Krishna. „Wir führen unsere Modelle auf diesem Bild aus, um eine sehr große Menge an Merkmalen zu extrahieren, ähnlich einem genomischen Panel; wir generieren Tausende von histologischen Lesungen [i.e. important image features]und nehmen Sie die wichtigsten, die Pathologen zwar untersuchen, aber nicht wirklich quantifizieren können. Sie sehen vielleicht, dass sie unterschiedlich sind, können die Unterschiede zwischen ihnen aber nicht messen.“
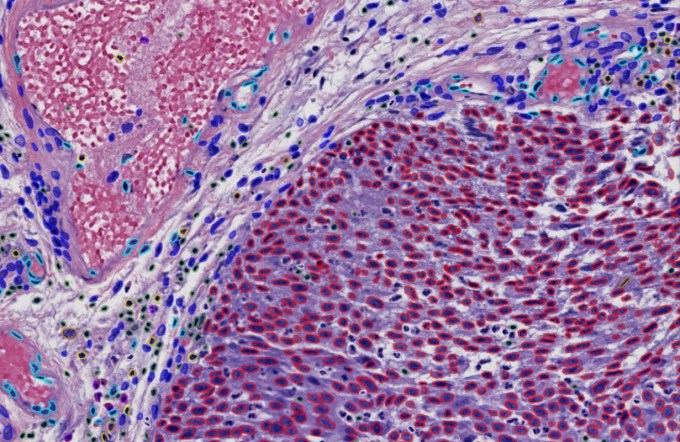
Joshi betonte ausdrücklich, dass sie den Pathologen nicht ersetzen, sondern unterstützen wollen. Man könnte es sich wie ein intelligentes Mikroskop vorstellen, das einem Experten hilft, genaue Messungen von Zellschäden, Immunreaktionen und anderen Strukturen vorzunehmen, die Aufschluss darüber geben, wie die Krankheit fortschreitet oder gehemmt wird.
„Letztendlich sitzt der Arzt immer am Steuer. Das sind einfach mehr Daten und das gefällt ihnen. Und Tests wie diese bieten eine fundierte externe Perspektive und das gefällt den Patienten sehr“, sagte Joshi.
Die Bildgebungskomponente, so das Team, wurde anhand von Unmengen an Daten trainiert und ist auf viele Bereiche und Krebsarten übertragbar. Das Zählen von Lymphozyten in Brustkrebsgewebe ist weitgehend dieselbe Aufgabe wie das Zählen in Hautkrebsgewebe. Was diese Zahl oder andere quantifizierbare Biomarker, die das Modell identifizieren kann, über die Wahrscheinlichkeit aussagt, dass der Patient auf die Behandlung anspricht, ist jedoch viel stärker auf bestimmte Erkrankungen beschränkt.
Dementsprechend ist die zweite Komponente des Valar-Systems das, was in einer bestimmten klinischen Situation wirklich berücksichtigt werden muss. Und zu diesem Zweck hat das Unternehmen nachgewiesen, dass sein Test im konkreten Fall von Blasenkrebs und der Standardbehandlung ein weitaus genauerer Indikator für den Erfolg ist als jede andere verfügbare Messgröße.
Risikofaktoren wie Alter, Gesundheitsgeschichte, Rauchen usw. sagen bestimmte Behandlungsergebnisse unterschiedlich aus, aber diese sind „sehr grob“, bemerkt Joshi. Valar behauptet, dass ihre KI-Modelle „alle diese Variablen übertreffen [in predictive power]und sind unabhängig von ihnen“ – was bedeutet, dass sie zusätzlich zum Standard-Risikofaktor verwendet werden können und nicht nur anstelle von ihm.
Sie wiesen auch darauf hin, dass es wichtig sei, die Ergebnisse interpretierbar zu halten: Das Letzte, was Ärzte oder Patienten brauchen, ist eine Black Box. Wenn also gesagt wird, dass ein Patient gut reagieren wird, wird dies dadurch unterstützt, dass „sein Immunsystem A macht und seine Zellkerne B machen usw.“
Das 2021 gegründete Unternehmen hat einen großen Teil seiner Anstrengungen darauf verwendet, das Bildmodell und sein erstes klinisches Modell für die oben erwähnte BCG-Therapie bei Patienten mit Blasenkrebs aufzubauen. Wie Valar in einer kürzlichen Ankündigung bemerkteder Test identifiziert Personen, bei denen das Risiko, nicht auf BCG zu reagieren, dreimal so hoch ist wie normal. Das bedeutet (nach Ermessen des Pflegeteams), dass es wahrscheinlich besser ist, etwas anderes auszuprobieren. Wenn dadurch auch nur ein Monat vergeudeter Anstrengungen gespart wird, könnte das für manche lebensverändernd sein.
Jeder, der selbst einmal eine Krebsbehandlung hinter sich hat, kann bestätigen, dass nicht nur jeder Behandlungstag unglaublich wertvoll ist, sondern dass es auch schwer ist, Vertrauen zu gewinnen. Valar bietet zwar keine Gewissheit (was in der Onkologie nahezu unmöglich ist), aber es könnte ein mächtiger Pfeil im Köcher der Pflegekräfte sein.
Zeitgleich mit der bevorstehenden Veröffentlichung seines ersten Produkts hat Valar eine Serie-A-Finanzierungsrunde im Wert von 22 Millionen US-Dollar abgeschlossen, die von DCVC und Andreessen Horowitz angeführt und von Pear VC begleitet wurde.
„Die Mittelbeschaffung kam genau zum richtigen Zeitpunkt“, sagte Joshi. „Wir konnten diese Validierung abschließen, und jetzt wird diese Finanzierung dazu beitragen, die Kommerzialisierung von Vesta voranzutreiben, und gleichzeitig beginnen wir mit der Ausweitung auf andere Krebsarten.“
Die Gründer sagten, sie hoffen auf eine stetige Expansion und verwenden dazu ein kommerzielles Labormodell, das dem der Genomtests der letzten Jahre sehr ähnlich ist, sagte COO Damir Vrabac: „Es ist den anderen Tests, die es vor uns gab, sehr ähnlich und verursacht keine Reibung im Gesundheitssystem.“ Dadurch können sie hoffentlich die Kosten auf die Versicherungsträger abwälzen und letztlich die Kosten der Versorgung insgesamt senken, indem sie unnötige und ineffektive Behandlungen vermeiden.

